本测试盒用间接竞争免疫分析法定量测定河豚鱼中的河豚毒素(TTX)。该测试盒反应孔可拆卸,可测单份样品,也可测多份样品。定量分析时需有含450nm波长的微孔板酶标仪。
1 概要
河豚毒素(TTX)是一种强神经毒素,其性质稳定,加热、盐腌及高温烹煮均不易使其被破坏。河豚鱼中常含有河豚毒素。我国沿海居民素有食用河豚鱼的习惯。因误食或食用加工不当的河豚鱼而发生人畜中毒的事件每年都有发生。故准确检测河豚鱼中的河豚毒素对预防和控制河豚毒素中毒,具有重要意义。本检测方法具有灵敏、快速、简便、特异性好、取样量小并可同时检测大量样品等优点。
2 测定原理
本试剂盒采用固相酶联免疫吸附原理,利用间接竞争ELISA法进行测定。用抗原包被微孔板,加入河豚毒素标准品或样品、抗河豚毒素单克隆抗体进行孵育后,将未与包被抗原结合的抗体洗去;再加入酶标记的抗鼠IgG抗体孵育,加入显色液,经过终止液终止后,用酶标仪在450nm处测定OD值。
3 提供的物品
微孔板
5个浓度的TTX标准溶液(各0.5mL)
标准1:0ng/mL ……………………………………………………………直接使用
标准2:10.0ng/mL ………………………………………………………直接使用
标准3:20.0ng/mL ………………………………………………………直接使用
标准4:50.0ng/mL ………………………………………………………直接使用
标准5:200.0ng/mL ………………………………………………………直接使用
抗体溶液(6mL) …………………………………………………………………直接使用
酶标物(12mL) …………………………………………………………………直接使用
显色液(12mL) …………………………………………………………………直接使用
终止液(6mL) ………………………………………………………………………直接使用
浓缩洗液(30mL) …………………………………………………………………稀释使用
4 盒中未提供,需自备物品
微孔板酶标仪(含450nm)、离心机、电炉、微量移液器、磁力搅拌器
量筒、漏斗、容量瓶、快速定性滤纸、分液漏斗
乙酸、氢氧化钠、去离子水或蒸馏水、PBS缓冲液
5 操作者注意事项
标准溶液中含有TTX毒素,应特别小心。
终止液为0.5M硫酸,避免接触皮肤。
每次加样后立即将所有试剂放回2
~8 ℃。
每步加样时间应控制在5min内。
孵育过程中应避光。
不要使用过期试剂盒。
不要交叉使用不同批号试剂盒中的试剂。
6 储存条件
保存试剂盒于
2~8℃。
不要冷冻
显色液对光敏感,因此要避免直接暴露在光线下。
将不用的微孔板放进原铝箔袋中,置
2~8℃保存。
7 试剂变质的标志
标准1的吸光度值小于0.5个单位(A
450nm<0.5)时,表示试剂可能变质。
8 样品处理
8.1 鲜河豚鱼中河豚毒素的检测
----称取5g河豚鱼样品(肌肉、皮或内脏),剪碎,加入25mL 0.1%的乙酸,用烧杯在电炉上煮沸搅拌10min。此步骤应注意不要让液体沸出容器,应控制加热温度,并不断搅拌。
----待冷却至室温后,上清用快速定性滤纸过滤于50mL离心管中
----沉淀用20mL0.1% 乙酸洗到烧杯中,再煮沸3min
----冷却至室温后,所有的液体及煮沸的样品都加到离心管中,3000rpm离心10min。
----取上清,量体积,置分液漏斗中
----加入等体积乙醚,振摇1分钟,静置分层。放出水层,量体积后至另一分液漏斗中,再加入等体积的乙醚,振摇1分钟,静止分层。
----将水层放入50mL容量瓶中,用1M氢氧化钠调节提取液中的pH值至6.5~7.4,然后加入PBS至50mL,提取液4℃保存备用。
8.2 鱼片、鱼干制品中河豚毒素的检测
-----样品中的TTX用0.1%乙酸在水浴中超声提取,提取液中的TTX用ELISA方法进行检测,若样品中TTX含量低于检出限则报告为<100mg/kg;样品中TTX含量在100~3000mg/kg之间,直接按ELISA实验结果报告;如果样品中TTX含量达到3000mg/kg,则需采用小鼠生物测定法进行验证,确认毒性反应后再按照ELISA实验结果报告。
9 酶免疫分析程序
----浓缩洗液为10倍浓缩液,使用时与去离子水或蒸馏水按体积比1:9稀释后使用。
----取所需数量的板条插入微孔架,用洗液洗涤微孔板3min×2次,记录样品及标准的位置。
----加入50mL标准品或处理好的样品到微孔,每个标准和样品必须使用新的吸头。
----加入50mL抗河豚毒素单克隆抗体溶液到每个微孔(注意移液器管尖不要接触到孔中的液体,避免交叉污染)中,37℃孵育90min。
----甩掉孔中液体,用洗液洗涤微孔板3min×3次,*后一次应在吸水纸上拍打以完全除去孔中液体。
----每孔加入酶标物100mL,37℃孵育60min。
----用洗液洗涤微孔板3min×5次,*后一次应在吸水纸上拍打以完全除去孔中液体。
----每孔加入显色液100mL(2滴),37℃孵育12min。
----每孔加入终止液50mL(1滴),立即用酶标仪在波长450nm处测定吸光度值(OD值)。
注:在定量分析中,显色液和终止液需要用移液器准确量取。
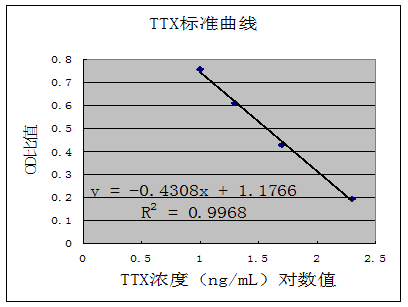
10 样品浓度计算
以标准溶液OD值与标准1的OD值的比值为纵坐标(即标准品OD比),所对应标准溶液浓度(ng/mL)的对数值为横坐标,制作标准曲线。根据样品OD值与标准1的OD的比值(即样品OD比),可从曲线上得到对应点的横坐标,即为TTX浓度的对数值,求得反对数即为测定液中TTX浓度C(ng/mL),按下列公式计算出样品中TTX含量:
TTX含量(mg/kg)= 10×C×K
式中:C:测定液中TTX浓度(ng/mL)
K:提取液的稀释倍数
11 主要技术指标及参数
11.1 *低检出浓度10.0 ng/mL。
11.2 加标回收率在70~120%,条内变异系数<10%,条件变异系数<15%。
附图(仅供参考)

 扫一扫,手机浏览
扫一扫,手机浏览







